
In dit artikel geven we een overzicht van verschillende vezels en laten we zien hoe intrinsieke vezels, dankzij de intacte plantcelstructuur, wellicht een meer complete voedingsbehandeling van obstipatie bieden.
Auteurs:
- Thom van den Brand
- WholeFiber Holding B.V., Emmeloord, Nederland.
- Afdeling Humane Voeding en Gezondheid, Wageningen Universiteit, Wageningen.
- Ben Witteman
- Afdeling Humane Voeding en Gezondheid, Wageningen Universiteit, Wageningen.
- Afdeling Gastro-enterologie en Hepatologie, Ziekenhuis Gelderse Vallei, Ede.
- Iris Rijnaarts
- WholeFiber Holding B.V., Emmeloord, Nederland.
- (E-mail: iris.rijnaarts@wholefiber.nl)
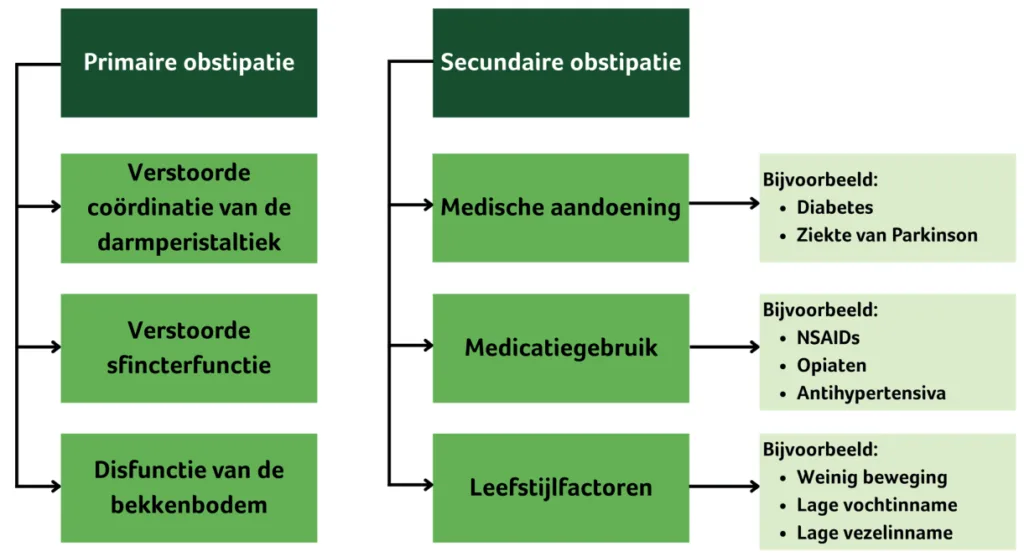
Obstipatie heeft in Nederland een prevalentie van 15%, en komt vooral voor bij vrouwen, ouderen en mensen met een lagere sociaaleconomische status (Suares & Ford, 2011; Verkuijl et al., 2020a). Het wordt gekenmerkt door onregelmatige, harde ontlasting met een gevoel van incomplete evacuatie (leging van de darmen) bij > 25% van de defecaties. De diagnose obstipatie wordt gesteld op basis van de NHG-richtlijn voor huisartsen (Diemel et al., 2010). Naast een verminderd welbevinden wordt obstipatie geassocieerd met een verhoogd risico op darmkanker, de ziekte van Parkinson en hart- en vaatziekten (Guérin et al., 2014; Sumida et al., 2019; Svensson et al., 2016). Afhankelijk van de oorzaak kan obstipatie worden onderverdeeld in primaire en secundaire obstipatie (figuur 1).
Vezelinname

Als het gaat om oorzaken van obstipatie, valt er voor de gemiddelde Nederlander onder andere winst te behalen op het gebied van vezelinname (Rijnaarts et al., 2022). Een lagere vezelinname is geassocieerd met een aanzienlijk verhoogde kans op obstipatieklachten. De Gezondheidsraad adviseert een dagelijkse vezelinname van >14 g/1000 kcal ter preventie van chronische ziekten en ter ondersteuning van de darmwerking. Dit komt overeen met 25 à 40 gram voedingsvezel per dag. De optimale vezelinname voor het bevorderen van de darmpassagesnelheid ligt echter hoger, namelijk tussen de 32-45 gram per dag. Deze aanbevelingen gelden voor vezels afkomstig uit de voeding, en niet voor de inname van geïsoleerde of gezuiverde vezelsupplementen. De Voedselconsumptiepeiling in Nederland heeft echter gemeten dat de gemiddelde inname slechts 21 gram per dag is. Hoewel de voedingsrichtlijnen geen onderscheid maken tussen vezelsoorten, is het bekend dat niet elke vezel dezelfde werking heeft (tabel 1).
Soorten vezels
Vezels werden oorspronkelijk onderverdeeld op basis van fermenteerbaarheid, oplosbaarheid en viscositeit (gelvormend vermogen). Vanwege overlap en beperkte toepasbaarheid zijn enkel fermenteerbaarheid en viscositeit (gelvormend vermogen) nu nog relevant.
Fermenteerbare vezels worden door darmbacteriën afgebroken, waarbij korte ketenvetzuren (KKV) zoals acetaat, propionaat en butyraat worden geproduceerd. Butyraat levert energie voor de colonocyten (darmwandcellen) en verbetert de werking ervan. KKV hebben een stabiliserend effect op de hersen-darm-as, versterken de darmbarrière en het immuunsysteem en stimuleren de peristaltiek van het colon, wat kan leiden tot het in stand houden van de gezondheid en kwaliteit van leven (Canani, 2011). Fermenteerbare vezels zitten onder andere in bonen, appels, prei, ui en de witlof(cichorei)wortel.
Niet-fermenteerbare vezels bevorderen de darmperistaltiek door het fecale volume te vergroten en vocht aan te trekken, wat de stoelgang verbetert en de darmpassage versnelt. Ze zitten bijvoorbeeld in granen en dan met name volkorenproducten, zemelen en psyllium (van der Schoot et al., 2022). Het onderscheid tussen vezelsoorten is niet strikt: fermenteerbare vezels kunnen ook mechanisch werken door het verhogen van bacteriële massa.
Prebiotische vezels zijn vezels die worden gefermenteerd door een specifieke groep bacteriën (selectieve fermentatie) en hierdoor causaal zijn gelinkt aan gezondheidsvoordelen, zoals een verbeterde stoelgang of een verlaging van het cholesterolgehalte.
Intrinsieke fermenteerbare vezels krijgen steeds meer erkenning. Deze bevinden zich in onbewerkte of minimaal bewerkte voeding waarvan het originele plantcelmatrix nog intact is, zoals in groente, fruit, noten en zaden. Hierdoor moet de celwand eerst door fermentatie worden opengebroken voordat deze ingekapselde vezels vrijkomen en gefermenteerd kunnen worden. Dit zorgt voor een geleidelijke vrijlating van vezels in het colon en een meer langdurig fermentatieproces.
Geraffineerde vezels worden door bewerkingsprocessen zoals malen of koken al vroeg in het colon gefermenteerd, terwijl intrinsieke vezels ook het distale colon bereiken, waar de grootste KKV-productie plaatsvindt en de KKV systemisch beschikbaar komen. Distale KKV hebben een grotere metabole impact dan proximale KKV (Neis et al., 2019; Puhlmann et al., 2022, 2024; van der Beek et al., 2016).
Behandeling van obstipatie
Bij alarmsymptomen als vrij acuut veranderd ontlastingspatroon of bloed bij de ontlasting is het verstandig eerst de huisarts te raadplegen om eventuele onderliggende problematiek uit te sluiten. De eerste stap bij de behandeling van functionele obstipatie is een leefstijladvies: meer vezels, vocht en beweging. Als de vezelinname via een vezelrijk dieet onvoldoende blijft, wordt meestal een geraffineerd vezelsupplement voorgeschreven zoals psyllium of sterculiagom. Werkt dit ook niet, dan volgt medicatie, zoals osmotische laxantia die water binden en zo de fecale consistentie en peristaltiek verbeteren (Diemel et al., 2010). Door de nadruk te leggen op niet-fermenteerbare of snel-fermenteerbare (bewerkte) vezels wordt slechts een deel van de gezondheidseffecten van vezels benut, terwijl de verhoging van natuurlijke voedingsvezels met een volwaardig vezelrijk dieet ook leidt tot een verbetering van obstipatieklachten (Rijnaarts et al., 2022). Een dieet rijk aan intrinsieke vezels kan naast de behandeling van obstipatie ook bijdragen aan een gezonder eetpatroon, doordat het samengaat met de inname van onbewerkte producten.
Overzicht vezeltypes en effect op stoelgang en darmmicrobioom
Een stoelgang wordt vooral als prettig ervaren bij een smeuïge consistentie en een regelmatige frequentie van de ontlasting met een gemiddelde darmpassagetijd van 30-40 uur. Bij obstipatie duurt dit langer, waardoor te veel vocht uit de ontlasting wordt opgenomen en deze een hardere consistentie krijgt. Dit leidt tot een onregelmatige en soms pijnlijke stoelgang, buikpijn en een opgeblazen gevoel. Vezels verkorten de darmpassagetijd, verhogen de stoelgangfrequentie en verbeteren ontlastingsconsistentie (Rijnaarts et al., 2022). De Bristol-stoelgangschaal wordt gebruikt om de consistentie te beoordelen: type 1-2 is hard/keutelig (obstipatie), type 3-4-5 is smeuïg/normaal en type 6-7 waterig/diarree. Naast deze fysieke effecten hebben vezels een belangrijk effect op het darmmicrobioom. Tabel 2 geeft een overzicht van de meest voorkomende vezelproducten en hun effecten op stoelgang en het microbioom.
Gedroogde cichoreiwortel, natief cichorei inuline, sterculiagom, fructo-oligosacchariden (FOS) en guargom zijn het meest effectief tegen obstipatie volgens tabel 2, op basis van het effect op kenmerken van obstipatie en het microbioom.
Natief cichorei inuline heeft een EFSA-claim voor een verhoogde stoelgangsfrequentie bij een dagelijkse inname van ≥12 gram per dag (EFSA, 2015). De initiële toename van gasvorming bij een grotere vezelinname is een natuurlijk gevolg van fermentatie en normaliseert vaak binnen enkele weken (Winham & Hutchins, 2011). Inuline stimuleert Bifidobacterium spp. maar heeft geen invloed op niet de darmpassagetijd (Le Bastard et al., 2020; Micka et al., 2017; Slavin & Feirtag, 2011).
Gedroogde cichoreiwortel is een natuurlijk product van Nederlandse bodem dat niet geraffineerd of chemisch geëxtraheerd is en hierdoor vier intrinsieke vezels bevat: inuline, pectine en (hemi-)cellulose (Puhlmann et al., 2024). Het verbetert de stoelgangsfrequentie en -consistentie bij mensen met prediabetes en versnelt de darmpassagetijd (Puhlmann et al., 2022; van der Belt et al., 2025). Momenteel wordt het effect van verschillende doseringen gedroogde chicoreiwortel bij mensen met obstipatie gevalideerd in onderzoek. Fermentatie van dit vezelproduct leidt tot een sterke verhoging van KKV-producerende bacteriën Bifidobacterium spp. en Anaerostipes spp., gepaard met een sterke toename (25%) van KKVs, waaronder butyraat (Puhlmann et al., 2022).
Sterculiagom, afkomstig van Sterculia-bomen, verbetert de stoelgangsfrequentie en -consistentie (Ivy & Isaacs, 1938). Bij patiënten met diverticulose en obstipatie verkort sterculiagom de darmpassagetijd (Srivastava et al., 1976). Wel zijn onderzoeken naar sterculiagom verouderd en uitgevoerd zonder controlegroep. Sterculiagom beïnvloedt het darmmicrobioom niet.
FOS verkort de darmpassagetijd en verbetert de stoelgangsfrequentie en -consistentie (Dou et al., 2022; Zhen et al., 2024). Het is een compleet geraffineerde vezel, vooral toegepast in kunstmatige zuigelingenvoeding. FOS verhoogt de hoeveelheid Bifidobacterium spp. maar heeft een beperkt effect op de KKV-productie (Dou et al., 2022; Zhen et al., 2024). De fermentatie van FOS kan de gasvorming ook doen toenemen en een opgeblazen gevoel veroorzaken, merkbaar bij een inname >10 gram per dag. Fructanen, waaronder FOS, worden vermeden in het FODMAP-dieet vanwege deze gasvormende eigenschappen. Hierdoor is FOS minder geschikt voor mensen met viscerale hypersensitiviteit en Prikkelbare Darm Syndroom (Chen et al., 2017; Zhen et al., 2024).
Ook guargom kan effectief zijn tegen obstipatie, maar heeft een niet-selectief effect op het darmmicrobioom en een beperkt effect op KKV-productie (Edelman et al., 2024; Reider et al., 2020). Muismodellen suggereren echter dat guargom een negatief effect heeft op de darmbarrière door microbioom veranderingen die leiden tot ophopingen van lactaat en succinaat, wat het colon kwetsbaarder maakt voor ontstekingen (Paudel et al., 2024).
In de klinische praktijk wordt psyllium veel gebruikt bij obstipatie, een vezel die beperkt gefermenteerd wordt en geen prebiotische eigenschappen heeft. Een voordeel hiervan is dat psyllium weinig gasvorming veroorzaakt en goed getolereerd wordt. Het verbetert stoelgangsconsistentie en -frequentie, maar beïnvloedt de darmpassagetijd en darmmicrobioom niet (Jalanka et al., 2019; van der Schoot et al., 2022b).
Lijnzaad bevat intrinsieke vezels en verbetert stoelgangsconsistentie en -frequentie, maar heeft geen selectief effect op het darmmicrobioom en beïnvloedt de KKV-productie niet (Lagkouvardos et al., 2015; Ma et al., 2022). Tevens geldt een bovengrens van 28 gram voor de inname van lijnzaad wegens de aanwezigheid van goïtrogenen en cyaniden.
Tarwezemelen bevorderen de stoelgang bij obstipatie, maar hebben geen effect op de KKV-productie en kunnen pijnklachten bij IBS-patiënten verergeren (Costabile et al., 2008; Hebden et al., 2002; Muller-Lissner, 1988). Fijngemalen tarwezemelen kunnen de ontlasting verharden en obstipatie verergeren omdat deze enkel bijdragen aan de droge massa van de stoelgang (McRorie et al., 2020).
Resistent zetmeel is een vermoedelijk prebiotische vezel met een effect op het darmmicrobioom en butyraat-vorming, echter is het effect op stoelgangsfrequentie en transitietijd beperkt (Klosterbuer et al., 2013; Shen et al., 2017).
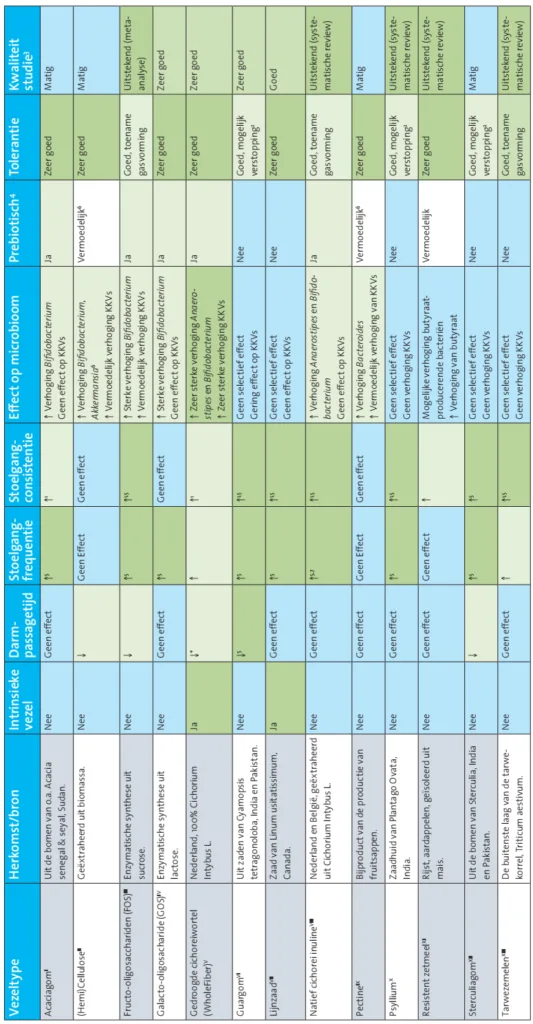
Afkortingen: KKV: korteketenvetzuur. 1 Gemeten met de Bristol-stoelgangschaal, 2 Risico op verstopping van slokdarm en verstikking wanneer ingenomen zonder voldoende vocht of bij slikproblemen (FDA, 2024), 3 Kwaliteit door GRADE-beoordelingssysteem. 4 Prebiotische eigenschap beoordeeld met ISAPP Checklist of Cumulative Required Evidence for a Prebiotic, 5 Donkergroen betekent onderzocht in mensen met obstipatieklachten, 6 Effecten gevonden in muisstudie, 7 Effect van consumptie van 12 gram natief chicorei inuline bevestigd in EFSA-claim. * Artikel in voorbereiding (van der Belt et al., 2025)
Bronvermelding: I (Cherbut et al., 2003; Eveleens Maarse et al., 2024; JanssenDuijghuijsen et al., 2024), II (Danjo et al., 2008; Deloule et al., 2020; Hillman et al., 1983), III (Dou et al., 2022; Zhen et al., 2024), IV (Schoemaker et al., 2022), V (Puhlmann et al., 2022, 2024; van der Belt et al., 2025), VI (Polymeros et al., 2014; Reider et al., 2020), VII (Ma et al., 2022; Soltanian & Janghorbani, 2019), VIII (Le Bastard et al., 2020; Micka et al., 2017), IX (An et al., 2019; Hillman et al., 1983), X (Jalanka et al., 2019; van der Schoot et al., 2022b), XI (Klosterbuer et al., 2013; Shen et al., 2017), XII (Ivy & Isaacs, 1938; Srivastava et al., 1976), XIII (Costabile et al., 2008; Hebden et al., 2002; McRorie et al., 2020; Muller-Lissner, 1988).
Intrinsieke vezels: langzaam gefermenteerd, bevordert darmperistaltiek en metabole gezondheid
KKVs afkomstig van vezelfermentatie stimuleren darmperistaltiek, werken ontstekingsremmend en versterken de darmbarrière (Canani, 2011; Fukumoto et al., 2003). Op metabool niveau verbeteren KKVs de glycemische respons en insulinegevoeligheid en stimuleren ze vetverbranding door binding aan vrije vetzuurreceptoren (de Vos et al., 2022; Müller et al., 2019). Butyraat stimuleert bovendien de afgifte van darmhormonen zoals Glucagon Like Peptide 1 (GLP-1), wat het verzadigingsgevoel bevordert (Müller et al., 2019). De langzame fermentatie van intrinsieke vezels leidt tot KKV-productie door het gehele colon en hiermee de stimulatie van de darmperistaltiek over het gehele colontraject, inclusief het sigmoïd. Onderzoek laat zien dat metabole effecten van KKV enkel optreden wanneer deze in het distale deel van de colon aanwezig zijn (Canfora et al., 2017; van der Beek et al., 2016). Dit onderscheidt intrinsieke vezels in gedroogde cichoreiwortel van de andere producten in tabel 2, welke snel fermenteren in het proximale colon. Door snelle fermentatie bereiken slechts een beperkte hoeveelheid KKVs het distale colon. In vitro onderzoek laat zien dat de fermentatie van intrinsieke vezels uit gedroogde cichoreiwortel tot minder gasvorming leidt in vergelijking met natief cichorei inuline poeder, waardoor ze beter getolereerd worden (Puhlmann et al., 2024). De intrinsieke vezelstructuur leidt bovendien tot een 24% hoger aandeel butyraat binnen de geproduceerde KKV (Puhlmann et al., 2024).
Discussie
Obstipatie is een veelvoorkomend probleem (Verkuijl et al., 2020b). Het verhogen van de vezelinname met onbewerkte voeding leidt vaak wel tot een klinische verbetering, maar kan voor sommige mensen een uitdaging zijn. Niet elke vezel heeft hetzelfde effect op de stoelgang en het darmmicrobioom. Gedroogde cichoreiwortel, natief cichorei inuline, FOS, sterculiagom en guargom lijken het meest effectief bij obstipatie, waarbij gedroogde cichoreiwortel de grootste impact heeft op de stoelgang, het darmmicrobioom en de KKV-productie. Hoewel er meer vezels bestaan dan in dit artikel behandeld zijn, zoals bijvoorbeeld bèta-glucanen, is de invloed van deze vezels op de stoelgang beperkt en zijn deze daarom buiten beschouwing gelaten.
Waar niet-fermenteerbare vezels de stoelgang mechanisch verbeteren door vergroting van het fecale volume via het aantrekken van water, worden intrinsieke vezels gefermenteerd in de darmen. Langzame fermentatie geeft de intrinsieke vezels gezondheidsbevorderende effecten, ook in het distale deel van het colon. De KKVs, met name butyraat, die vrijkomen bij fermentatie, hebben een stimulerend effect op de darmperistaltiek door binding aan 5-hydroxytryptamine (5-HT) receptoren in de darmwand. De intrinsieke vezelstructuur bevordert bovendien het darmmicrobioom, de darmbarrière en vermindert gasvorming (Canani, 2011; Fukumoto et al., 2003; Puhlmann et al., 2024).
Het darmmicrobioom heeft een complexe individueel bepaalde samenstelling; niet alleen wélke bacteriën, maar ook hun functies en interacties zijn belangrijk. Hoewel we nog niet precies weten wat een ‘gezond’ darmmicrobioom is, is bekend dat bepaalde aspecten duiden op beter darmmicrobioom en gezondheid, zoals hoge KKV-productie (vooral butyraat), aanwezigheid van Bifidobacterium spp. en andere butyraat-vormende bacteriën (Joos et al., 2024). KKV-productie vindt echter niet plaats bij kleine veranderingen in het dieet; deze treden op bij grote dieetveranderingen zoals 50 gram vezels per dag (O’Keefe et al., 2015; Rijnaarts et al., 2022). De toevoeging van circa 15 gram gedroogde cichoreiwortel naast een vezelrijk dieet maakt deze verandering makkelijker haalbaar.
Langzame fermentatie van intrinsieke vezels verhoogt KKV-productie in onder andere het distale colon, zichtbaar in de ontlasting. Hoewel het meten van KKV in de ontlasting een veelgebruikte methode is om uitspraak te doen over de KKV-productie in de darmen, heeft het beperkingen. Ontlastingsmetingen schatten de resterende KKV na opname door colonocyten en zeggen weinig over circulerende KKVs. Bloedmetingen geven ook geen volledig beeld, omdat KKV grotendeels via de poortader door de lever worden opgenomen en snel gemetaboliseerd (Sakata, 2019). Toekomstige biomarkers kunnen inzicht geven in het verband tussen darmmicrobioom, KKV-productie, vezelinname en gezondheid. Toch bieden de huidige onderzoeksmethoden al een mogelijkheid om veranderingen in het darmmicrobioom en de KKV-productie te linken aan klinische effecten. Door deze inzichten te koppelen aan mechanistische inzichten, zoals de werking van KKV, kunnen we met zekerheid stellen dat sommige vezels prebiotische effecten hebben en mogelijk bijdragen aan een goede stoelgang, het voorkomen van chronische (welvaart)ziektes en een betere algemene gezondheid (Canani, 2011).
Conclusie
Naast het standaard advies van een vezelrijker eetpatroon, richt de huidige praktijk zich vooral op niet/gedeeltelijk-fermenteerbare vezels of laxantia in de behandeling van functionele obstipatie. De eerste stap in de behandeling van obstipatieklachten moet naar onze mening de nadruk leggen op het verhogen van de intrinsieke vezelinname uit bijvoorbeeld groente, fruit, noten, zaden en volkoren graanproducten. Toevoeging van intrinsieke prebiotische vezels aan het dieet kan helpen bij obstipatieklachten en is daarnaast gunstig voor het darmmicrobioom, de KKV- en butyraatproductie en daarmee de (metabole) gezondheid.
Disclosure
TvdB and IR zijn werkzaam bij WholeFiber Holding BV. BW heeft geen conflict of interest.
Literatuur:
- An, R., Wilms, E., Smolinska, A., Hermes, G. D. A., Masclee, A. A. M., de Vos, P., Schols, H. A., van Schooten, F. J., Smidt, H., Jonkers, D. M. A. E., Zoetendal, E. G., & Troost, F. J. (2019). Sugar Beet Pectin Supplementation Did Not Alter Profiles of Fecal Microbiota and Exhaled Breath in Healthy Young Adults and Healthy Elderly. Nutrients, 11(9), 2193. https://doi.org/10.3390/nu11092193
- Bastard, Q. le, Chapelet, G., Javaudin, F., Lepelletier, D., Batard, E., & Montassier, E. (2020). The effects of inulin on gut microbial composition: a systematic review of evidence from human studies. European Journal of Clinical Microbiology & Infectious Diseases, 39(3), 403–413. https://doi.org/10.1007/s10096-019-03721-w
- Canani, R. B. (2011). Potential beneficial effects of butyrate in intestinal and extraintestinal diseases. World Journal of Gastroenterology, 17(12), 1519. https://doi.org/10.3748/wjg.v17.i12.1519
- Canfora, E. E., van der Beek, C. M., Jocken, J. W. E., Goossens, G. H., Holst, J. J., Damink, S. W. M. O., Lenaerts, K., Dejong, C. H. C., & Blaak, E. E. (2017). Colonic infusions of short-chain fatty acid mixtures promote energy metabolism in overweight/obese men: a randomized crossover trial. Scientific Reports, 7(1), 2360. https://doi.org/10.1038/s41598-017-02546-x
- Chen, B.-R., Du, L.-J., He, H.-Q., Kim, J. J., Zhao, Y., Zhang, Y.-W., Luo, L., & Dai, N. (2017). Fructo-oligosaccharide intensifies visceral hypersensitivity and intestinal inflammation in a stress-induced irritable bowel syndrome mouse model. World Journal of Gastroenterology, 23(47), 8321–8333. https://doi.org/10.3748/wjg.v23.i47.8321
- Cherbut, C., Michel, C., Raison, V., Kravtchenko, T., & Severine, M. (2003). Acacia Gum is a Bifidogenic Dietary Fibre with High Digestive Tolerance in Healthy Humans. Microbial Ecology in Health and Disease, 15(1), 43–50. https://doi.org/10.1080/08910600310014377
- Costabile, A., Klinder, A., Fava, F., Napolitano, A., Fogliano, V., Leonard, C., Gibson, G. R., & Tuohy, K. M. (2008). Whole-grain wheat breakfast cereal has a prebiotic effect on the human gut microbiota: a double-blind, placebo-controlled, crossover study. British Journal of Nutrition, 99(1), 110–120. https://doi.org/10.1017/S0007114507793923
- Danjo, K., Sakamoto, J., Iwane, S., Tamura, K., Nakaji, S., Fukuda, S., Murakami, H., Shimoyama, T., Takahashi, I., & Umeda, T. (2008). Effects of Cellulose Supplementation on Fecal Consistency and Fecal Weight. Digestive Diseases and Sciences, 53(3), 712–718. https://doi.org/10.1007/s10620-007-9938-6
- de Vos, W. M., Tilg, H., Hul, M. van, & Cani, P. D. (2022). Gut microbiome and health: mechanistic insights. Gut, 71(5), 1020–1032. https://doi.org/10.1136/gutjnl-2021-326789
- Deloule, V., Boisset, C., Hannani, D., Suau, A., Gouellec, A. le, Chroboczek, J., Botté, C., Yamaryo-Botté, Y., Chirat, C., & Toussaint, B. (2020). Prebiotic role of softwood hemicellulose in healthy mice model. Journal of Functional Foods, 64, 103688. https://doi.org/10.1016/j.jff.2019.103688
- Diemel, J. M., den Hurk, A. van, Muris, J. W. M., Pijpers, M. A. M., & Verheij, A. A. A. (2010). NHG-Standaard Obstipatie. Huisarts En Wetenschap, 53(9), 484–498. https://doi.org/10.1007/BF03089256
- Dou, Y., Yu, X., Luo, Y., Chen, B., Ma, D., & Zhu, J. (2022). Effect of Fructooligosaccharides Supplementation on the Gut Microbiota in Human: A Systematic Review and Meta-Analysis. Nutrients, 14(16), 3298. https://doi.org/10.3390/nu14163298
- EFSA. (2015). Scientific Opinion on the substantiation of a health claim related to “native chicory inulin” and maintenance of normal defecation by increasing stool frequency pursuant to Article 13.5 of Regulation (EC) No 1924/2006. EFSA Journal, 13(1), 3951. https://doi.org/10.2903/j.efsa.2015.3951
- Fukumoto, S., Tatewaki, M., Yamada, T., Fujimiya, M., Mantyh, C., Voss, M., Eubanks, S., Harris, M., Pappas, T. N., & Takahashi, T. (2003). Short-chain fatty acids stimulate colonic transit via intraluminal 5-HT release in rats. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 284(5), R1269–R1276. https://doi.org/10.1152/ajpregu.00442.2002
- Gibson, G. R., Hutkins, R., Sanders, M. E., Prescott, S. L., Reimer, R. A., Salminen, S. J., Scott, K., Stanton, C., Swanson, K. S., Cani, P. D., Verbeke, K., & Reid, G. (2017). Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nature Reviews Gastroenterology & Hepatology, 14(8), 491–502. https://doi.org/10.1038/nrgastro.2017.75
- Guérin, A., Mody, R., Fok, B., Lasch, K. L., Zhou, Z., Wu, E. Q., Zhou, W., & Talley, N. J. (2014). Risk of developing colorectal cancer and benign colorectal neoplasm in patients with chronic constipation. Alimentary Pharmacology & Therapeutics, 40(1), 83–92. https://doi.org/10.1111/apt.12789
- Hebden, J. M., Blackshaw, E., D’Amato, M., Perkins, A. C., & Spiller, R. C. (2002). Abnormalities of GI transit in bloated irritable bowel syndrome: effect of bran on transit and symptoms. The American Journal of Gastroenterology, 97(9), 2315–2320. https://doi.org/10.1111/j.1572-0241.2002.05985.x
- Hillman, L., Peters, S., Fisher, A., & Pomare, E. W. (1983). Differing effects of pectin, cellulose and lignin on stool pH, transit time and weight. British Journal of Nutrition, 50(2), 189–195. https://doi.org/10.1079/BJN19830088
- Ivy, A. C., & Isaacs, B. L. (1938). Karaya gum as a mechanical laxative an experimental study on animals and man. American Journal of Digestive Diseases, 5(5), 315–321. https://doi.org/10.1007/BF03020553
- Jalanka, J., Major, G., Murray, K., Singh, G., Nowak, A., Kurtz, C., Silos-Santiago, I., Johnston, J. M., de Vos, W. M., & Spiller, R. (2019). The Effect of Psyllium Husk on Intestinal Microbiota in Constipated Patients and Healthy Controls. International Journal of Molecular Sciences, 20(2), 433. https://doi.org/10.3390/ijms20020433
- JanssenDuijghuijsen, L., van den Belt, M., Rijnaarts, I., Vos, P., Guillemet, D., Witteman, B., & de Wit, N. (2024). Acacia fiber or probiotic supplements to relieve gastrointestinal complaints in patients with constipation-predominant IBS: a 4-week randomized double-blinded placebo-controlled intervention trial. European Journal of Nutrition, 63(5), 1983–1994. https://doi.org/10.1007/s00394-024-03398-8
- Joos, R., Boucher, K., Lavelle, A., Arumugam, M., Blaser, M. J., Claesson, M. J., Clarke, G., Cotter, P. D., Sordi, L. de, Dominguez-Bello, M. G., Dutilh, B. E., Ehrlich, S. D., Ghosh, T. S., Hill, C., Junot, C., Lahti, L., Lawley, T. D., Licht, T. R., Maguin, E., … Ross, R. P. (2024). Examining the healthy human microbiome concept. Nature Reviews Microbiology. https://doi.org/10.1038/s41579-024-01107-0
- Klosterbuer, A. S., Hullar, M. A. J., Li, F., Traylor, E., Lampe, J. W., Thomas, W., & Slavin, J. L. (2013). Gastrointestinal effects of resistant starch, soluble maize fibre and pullulan in healthy adults. British Journal of Nutrition, 110(6), 1068–1074. https://doi.org/10.1017/S0007114513000019
- Ma, J., Sun, J., Bai, H., Ma, H., Wang, K., Wang, J., Yu, X., Pan, Y., & Yao, J. (2022). Influence of Flax Seeds on the Gut Microbiota of Elderly Patients with Constipation. Journal of Multidisciplinary Healthcare, Volume 15, 2407–2418. https://doi.org/10.2147/JMDH.S379708
- Maarse, B. C. E., Eggink, H. M., Warnke, I., Bijlsma, S., van den Broek, T. J., Oosterman, J. E., Caspers, M. P. M., Sybesma, W., Gal, P., van Kraaij, S. J. W., Schuren, F. H. J., Moerland, M., & Hoevenaars, F. P. M. (2024). Impact of fibre supplementation on microbiome and resilience in healthy participants: A randomized, placebo-controlled clinical trial. Nutrition, Metabolism and Cardiovascular Diseases, 34(6), 1416–1426. https://doi.org/10.1016/j.numecd.2024.01.028
- McRorie, J. W., Fahey, G. C., Gibb, R. D., & Chey, W. D. (2020). Laxative effects of wheat bran and psyllium: Resolving enduring misconceptions about fiber in treatment guidelines for chronic idiopathic constipation. Journal of the American Association of Nurse Practitioners, 32(1), 15–23. https://doi.org/10.1097/JXX.0000000000000346
- Micka, A., Siepelmeyer, A., Holz, A., Theis, S., & Schön, C. (2017). Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. International Journal of Food Sciences and Nutrition, 68(1), 82–89. https://doi.org/10.1080/09637486.2016.1212819
- Müller, M., Hernández, M. A. G., Goossens, G. H., Reijnders, D., Holst, J. J., Jocken, J. W. E., van Eijk, H., Canfora, E. E., & Blaak, E. E. (2019). Circulating but not faecal short-chain fatty acids are related to insulin sensitivity, lipolysis and GLP-1 concentrations in humans. Scientific Reports, 9(1), 12515. https://doi.org/10.1038/s41598-019-48775-0
- Muller-Lissner, S. A. (1988). Effect of wheat bran on weight of stool and gastrointestinal transit time: a meta analysis. BMJ, 296(6622), 615–617. https://doi.org/10.1136/bmj.296.6622.615
- Neis, E. P. J. G., van Eijk, H. M. H., Lenaerts, K., Damink, S. W. M. O., Blaak, E. E., Dejong, C. H. C., & Rensen, S. S. (2019). Distal versus proximal intestinal short-chain fatty acid release in man. Gut, 68(4), 764–765. https://doi.org/10.1136/gutjnl-2018-316161
- O’Keefe, S. J. D., Li, J. v, Lahti, L., Ou, J., Carbonero, F., Mohammed, K., Posma, J. M., Kinross, J., Wahl, E., Ruder, E., Vipperla, K., Naidoo, V., Mtshali, L., Tims, S., Puylaert, P. G. B., DeLany, J., Krasinskas, A., Benefiel, A. C., Kaseb, H. O., … Zoetendal, E. G. (2015). Fat, fibre and cancer risk in African Americans and rural Africans. Nature Communications, 6(1), 6342. https://doi.org/10.1038/ncomms7342
- Paudel, D., Nair, D. V. T., Tian, S., Hao, F., Goand, U. K., Joseph, G., Prodes, E., Chai, Z., Robert, C. E. M., Chassaing, B., Patterson, A. D., & Singh, V. (2024). Dietary fiber guar gum-induced shift in gut microbiota metabolism and intestinal immune activity enhances susceptibility to colonic inflammation. Gut Microbes, 16(1). https://doi.org/10.1080/19490976.2024.2341457
- Polymeros, D., Beintaris, I., Gaglia, A., Karamanolis, G., Papanikolaou, I. S., Dimitriadis, G., & Triantafyllou, K. (2014). Partially Hydrolyzed Guar Gum Accelerates Colonic Transit Time and Improves Symptoms in Adults with Chronic Constipation. Digestive Diseases and Sciences, 59(9), 2207–2214. https://doi.org/10.1007/s10620-014-3135-1
- Puhlmann, M.-L., Jokela, R., van Dongen, K. C. W., Bui, T. P. N., van Hangelbroek, R. W. J., Smidt, H., de Vos, W. M., & Feskens, E. J. M. (2022). Dried chicory root improves bowel function, benefits intestinal microbial trophic chains and increases faecal and circulating short chain fatty acids in subjects at risk for type 2 diabetes. Gut Microbiome, 3, e4. https://doi.org/10.1017/gmb.2022.4
- Puhlmann, M.-L., van de Rakt, E., Kerezoudi, E. N., Rangel, I., Brummer, R. J., Smidt, H., Kaper, F. S., & de Vos, W. M. (2024). Analysis of the fermentation kinetics and gut microbiota modulatory effect of dried chicory root reveals the impact of the plant-cell matrix rationalizing its conversion in the distal colon. Microbiome Research Reports, 3(3). https://doi.org/10.20517/mrr.2024.04
- Reider, S. J., Moosmang, S., Tragust, J., Trgovec-Greif, L., Tragust, S., Perschy, L., Przysiecki, N., Sturm, S., Tilg, H., Stuppner, H., Rattei, T., & Moschen, A. R. (2020). Prebiotic Effects of Partially Hydrolyzed Guar Gum on the Composition and Function of the Human Microbiota—Results from the PAGODA Trial. Nutrients, 12(5), 1257. https://doi.org/10.3390/nu12051257
- Rijnaarts, I., de Roos, N. M., Wang, T., Zoetendal, E. G., Top, J., Timmer, M., Hogenelst, K., Bouwman, E. P., Witteman, B., & de Wit, N. (2022). A high-fibre personalised dietary advice given via a web tool reduces constipation complaints in adults. Journal of Nutritional Science, 11, e31. https://doi.org/10.1017/jns.2022.27
- Sakata, T. (2019). Pitfalls in short‐chain fatty acid research: A methodological review. Animal Science Journal, 90(1), 3–13. https://doi.org/10.1111/asj.13118
- Schoemaker, M. H., Hageman, J. H. J., ten Haaf, D., Hartog, A., Scholtens, P. A. M. J., Boekhorst, J., Nauta, A., & Bos, R. (2022). Prebiotic Galacto-Oligosaccharides Impact Stool Frequency and Fecal Microbiota in Self-Reported Constipated Adults: A Randomized Clinical Trial. Nutrients, 14(2), 309. https://doi.org/10.3390/nu14020309
- Shen, D., Bai, H., Li, Z., Yu, Y., Zhang, H., & Chen, L. (2017). Positive effects of resistant starch supplementation on bowel function in healthy adults: a systematic review and meta-analysis of randomized controlled trials. International Journal of Food Sciences and Nutrition, 68(2), 149–157. https://doi.org/10.1080/09637486.2016.1226275
- Slavin, J., & Feirtag, J. (2011). Chicory inulin does not increase stool weight or speed up intestinal transit time in healthy male subjects. Food Funct., 2(1), 72–77. https://doi.org/10.1039/C0FO00101E
- Soltanian, N., & Janghorbani, M. (2019). Effect of flaxseed or psyllium vs. placebo on management of constipation, weight, glycemia, and lipids: A randomized trial in constipated patients with type 2 diabetes. Clinical Nutrition ESPEN, 29, 41–48. https://doi.org/10.1016/j.clnesp.2018.11.002
- Srivastava, G. S., Smith, A. N., & Painter, N. S. (1976). Sterculia bulk-forming agent with smooth-muscle relaxant versus bran in diverticular disease. BMJ, 1(6005), 315–318. https://doi.org/10.1136/bmj.1.6005.315
- Sumida, K., Molnar, M. Z., Potukuchi, P. K., Thomas, F., Lu, J. L., Yamagata, K., Kalantar-Zadeh, K., & Kovesdy, C. P. (2019). Constipation and risk of death and cardiovascular events. Atherosclerosis, 281, 114–120. https://doi.org/10.1016/j.atherosclerosis.2018.12.021
- Svensson, E., Henderson, V. W., Borghammer, P., Horváth-Puhó, E., & Sørensen, H. T. (2016). Constipation and risk of Parkinson’s disease: A Danish population-based cohort study. Parkinsonism & Related Disorders, 28, 18–22. https://doi.org/10.1016/j.parkreldis.2016.05.016
- van der Beek, C. M., Canfora, E. E., Lenaerts, K., Troost, F. J., Damink, S. W. M. O., Holst, J. J., Masclee, A. A. M., Dejong, C. H. C., & Blaak, E. E. (2016). Distal, not proximal, colonic acetate infusions promote fat oxidation and improve metabolic markers in overweight/obese men. Clinical Science, 130(22), 2073–2082. https://doi.org/10.1042/CS20160263
- van der Belt et al. (2025). Effects of high-dietary fiber and high-fermented food diets on gut microbiota, immune function and dietary behavior in healthy adults: a randomized placebo-controlled nutritional trial. In Preparation.
- van der Schoot, A., Drysdale, C., Whelan, K., & Dimidi, E. (2022). The Effect of Fiber Supplementation on Chronic Constipation in Adults: An Updated Systematic Review and Meta-Analysis of Randomized Controlled Trials. The American Journal of Clinical Nutrition, 116(4), 953–969. https://doi.org/10.1093/ajcn/nqac184
- Verkuijl, S. J., Meinds, R. J., Trzpis, M., & Broens, P. M. A. (2020). The influence of demographic characteristics on constipation symptoms: a detailed overview. BMC Gastroenterology, 20(1), 168. https://doi.org/10.1186/s12876-020-01306-y
- Winham, D. M., & Hutchins, A. M. (2011). Perceptions of flatulence from bean consumption among adults in 3 feeding studies. Nutrition Journal, 10(1), 128. https://doi.org/10.1186/1475-2891-10-128
- Zhen, H., Qian, H., Liu, X., & Tan, C. (2024). Fructooligosaccharides for Relieving Functional Constipation: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Foods, 13(24), 3993. https://doi.org/10.3390/foods13243993



0 responses on "Opinieartikel: De rol van intrinsieke vezels in de behandeling van obstipatie"